VORGÄNGE AN DEN ELEKTRODE
Ionentransport zwischen Elektrolyt und Elektrode
Anode und Kathode
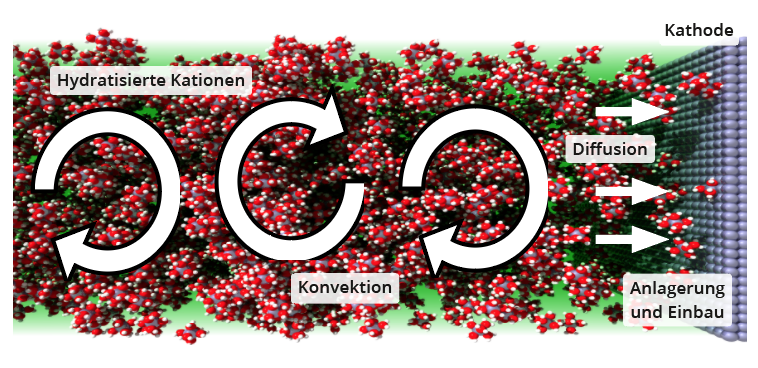
Alle im folgenden beschriebenen Transportmechanismen zwischen Elektrolyt und Elektroden gelten gleichermaßen für den Transport weg von der Elektrode wie auch hin zu ihr. Beschrieben wird deshalb stellver-tretend für beide Transportrichtungen der Transport von Kationen zur Kathode (siehe Schema unten).
Konvektion im Volumen
Die Diffusionsbewegung durch die thermische Bewegung der Teilchen wie auch die Driftbewegung im elektrischen Feld der Elektroden ist zu gering, um eine galvanische Abscheidung mit der erforderlichen Rate aufrecht zu erhalten, wenn der Bereich in unmittelbarer Nähe der Elektrode bereits an geeigneten Ionen verarmt ist. Deshalb ist eine Konvektion des Elektrolyten unerlässlich. Eine solche makroskopsiche Umwälzung aller Teilchen des Elektrolyten muss nicht zwingend von außen vorgegeben werden, sondern findet bereits durch räumliche Temperatur- und damit Dichteunterschiede im Elektrolyten statt. Konvektion alleine kann Teilchen jedoch nicht bis unmittelbar an die Elektrode heranführen, da sich in bewegten Flüssigkeiten über Festkörpern stets eine Diffusionsgrenzschicht ausbildet, deren Stärke mit zunehmender Konvektionsgeschwindigkeit jedoch abnimmt.
Diffusion in der Grenzschicht
Die Teilchen unmittelbar an der Elektrodenoberfläche haften an dieser, sind also an diese physikalisch durch verschiedene Wechselwirkungskräfte relativ schwach gebunden. Darüber lassen sich parallel zur Elektrodenoberfläche gestapelte Teilchenschichten denken, die sich mit jeweils bestimmtem Geschwindigkeitsunterschied parallel zur vorherigen Schicht bewegen können. Ab einem bestimmten Abstand geht diese Diffusionsschicht in den konvektiven Bereich des Elektrolyten über.Innerhalb der Diffusionsschicht nimmt die Konzentration der Ionen, welche sich an der Elektrode durch Aufwachsen (z. B. Cu+ + e- → Cu) oder Phasenumwandlung (z. B. 2 H+ + 2 e- → H2) verbrauchen, in Richtung der als „Teilchen-Senke“ fungierenden Elektrode ab. Dieser Konzentrationsgradient als treibende Kraft ist umso größer, je dünner die Diffusionsschicht, also je stärker die Konvektionsgeschwindigkeit darüber ist. Eine starke Konvektion fördert deshalb auch die Diffusion durch die Diffusionsgrenzschicht.
Anlagerung an die Elektrode
Kationen sind in wässrigen Lösungen stets hydratisiert, also aufgrund der Ion-Dipol-Wechselwirkung von einer Hydrathülle aus zum Ion ausgerichteten Wasser-Molekülen umgeben. Diese Hülle muss zunächst abgestreift werden, bevor sich das Kation an die Kathode anlagern kann.
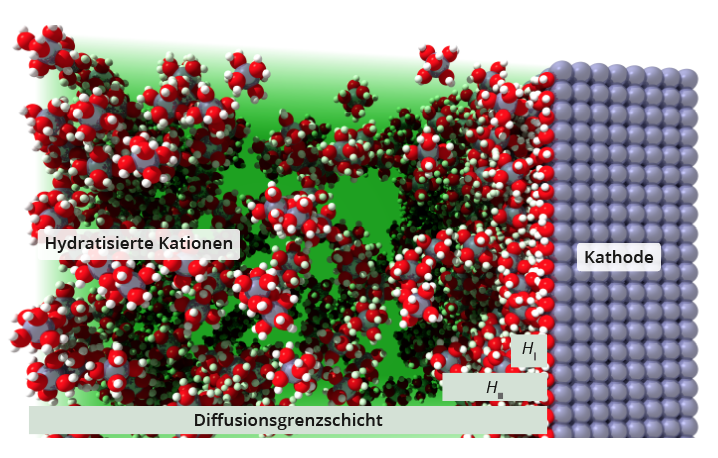
Eine genauere Betrachtung der Diffusionsgrenzschicht
Innerhalb der Diffusionsgrenzschicht lassen sich zwei Bereiche definieren:Die innere Helmholtzschicht bezeichnet die an die Elektrode adsorbierte Monolage der Lösemittelmoleküle (z. B. H2O) oder anderer Ionen des Elektrolyten.Die äußere Helmholtzschicht besteht aus den hydratisierten Ionen des Elektrolyten, welche an der inneren Helmholtzschicht angelagert sind.Um aus dem Elektrolyten an die Oberfläche der Elektrode zu gelangen (oder von der Elektrode in Lösung zu gehen), müssen die Ionen die Helmholtzschicht durchdringen, was als Durchtrittsreaktion bezeichnet wird. Anschließend streifen die Ionen ihre Hydrathülle ab und werden ins Gitter des Festkörpers eingebaut. Der Durchtritt durch die Grenzschicht wie auch das Abstreifen der Hydrathülle erfordert eine Aktivierungsenergie, die durch eine erhöhte Spannung (Durchtrittsüberspannung) an der externen Spannungsquelle aufgebracht werden muss.
Schichtwachstum
Physikalische Grundlagen
Nachdem die Kationen zur Kathode gelangt sind und ihre Hydrathülle abgestreift haben, lagern sie sich zunächst lose gebunden als Ad-Atome an die Oberfläche des Festkörpers an. Sie können dort thermisch aktiviert diffundieren, bis sie an einem energetisch günstigen Platz dauerhaft ins Kristallgefüge eingebaut werden.
Simulation...
Die folgenden Simulationen stellen den Mechanismus der Anlagerung und Einbau eines Kations in den Festkörper sehr vereinfacht dar: Jedes Teilchen in einem kubischen Gitter hat 26 Nachbarplätze (6 über die Seitenflächen, 12 über die Kanten, und 8 über die Ecken der zentralen Zelle), die jeweils besetzt oder unbesetzt sein können. Je mehr besetzte Nachbarn ein Teilchen hat (wobei die Nachbarplätze über die Kanten und Ecken durch den größeren Abstand weniger beitragen), desto größer ist dessen Bindungsenergie an diesem Ort. Die Wahrscheinlichkeit p für einen thermisch aktivierten Wechsel von einer Gitterstelle (Energie E1) zu einer benachbarten Stelle (E2) ist demnach:



...und Praxis
Die Realität der galvanischen Abscheidung ist wesentlich komplexer als die Annahmen der hier behandelten Simulationen:
Elektroden
sind i. d. Regel keine Einkristalle, sondern amorphe oder
nanokristalline Festkörper, wodurch die Bindungsverhältnisse auf deren
Oberfläche örtlich verschieden sind.Unberücksichtigt blieben auch die
Transportmechanismen innerhalb der Diffusionsgrenzschicht, v. a. der
Durchtritt durch die innere und äußere Helmholtzschicht. Auch das
Abstreifen der Hydrathülle und chemische Reaktionen wirken sich auf die
Energiebilanz eines Teilchens zwischen Anlagerung und Einbau ins
Kristallgefüge aus.




















